Micropropagation of Agave angustifolia Haw., for use and conservation purposes
DOI:
https://doi.org/10.29298/rmcf.v16i88.1504Keywords:
mezcal production, agave propagation, in vitro propagation, agaves, forestry biotechnology, xeric scrubAbstract
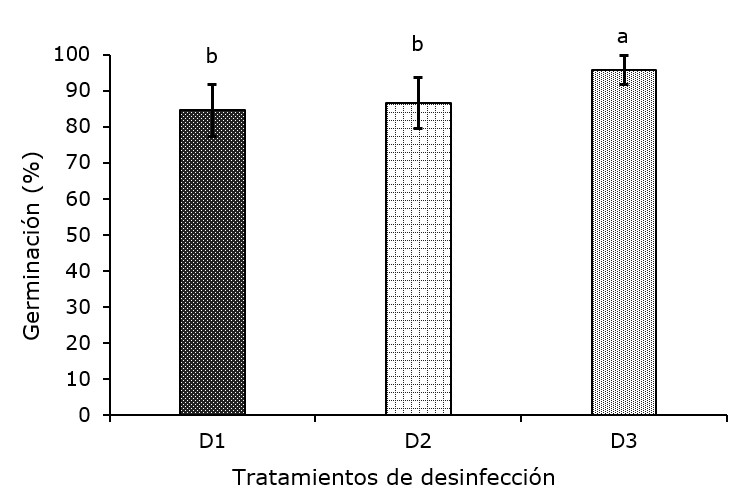
Agave angustifolia is a species utilized as raw material for mescal production in the South of the Estado de México, which is why the demand for the establishment of plantations of this succulent has increased. Plant tissue culture offers an alternative for mass plant propagation; thus, the objective of the present research was to develop a protocol for the in vitro propagation of the species. Germination, shoot multiplication and elongation, and root formation took place under in vitro conditions, and the plants were acclimatized in the nursery. The germination percentage was higher than 80 %, and there were differences between disinfection treatments and culture media. The use of 100 % MS medium+0.003 mg L-1 of BAP+0.002 mg L-1 of IBA+0.1 mg L-1 of calcium pantethonate produced a higher number of shoots per plant at 90 and 120 days. With 75 % MS culture medium, 100 % rooting was obtained, with an average of 6.5 roots per plant and 45 mm root length. In the nursery acclimatization stage, there was 100 % survival in the three substrates evaluated and differences were observed in height, diameter and dry matter. In conclusion, a complete protocol was generated for the micropropagation of Agave angustifolia, from in vitro germination to acclimatization in nursery.
Downloads
References
Aguilar J., D., y Rodríguez de la O, J. L. (2018). Micropropagación y aclimatación de Maguey Pitzometl (Agave marmorata Roezl) en la Mixteca Poblana. Revista Colombiana de Biotecnología, 20(2), 124-131. https://doi.org/10.15446/rev.colomb.biote.v20n2.77084
Aguilar-Rito, M. G., Arzate-Fernández, A. M., García-Núñez, H. G., y Norman-Mondragón, T. H. (2024). Establecimiento de un protocolo eficiente de desinfección in vitro en semillas de siete especies de Agave spp. Mexican Journal of Phytopathology, 42(1), 5. https://www.rmfito.smf.org.mx/volumenes/4212024/articulos/5.%20RMF2310-1.%20Espa%C3%B1ol.pdf
Andrade D., D., Córdoba F., M. E., Criollo E., H., y Lagos B., T. C. (2013). Evaluación de medios de cultivo para propagación in vitro de semillas y explantes de especies silvestres de Solanum. Acta Agronómica, 62(1), 27-36. https://repositorio.unal.edu.co/bitstream/handle/unal/37275/25153-187505-2-PB.pdf?sequence=1&isAllowed=y
Ángeles-Espino, A., Valencia-Botín, A. J., Virgen-Calleros, G., Ramírez-Serrano, C., Paredes-Gutiérrez, L., y Hurtado-de la Peña, S. (2012). Micropropagación de agave (Agave tequilana Weber. var. Azul) a través de yemas axilares. Tropical and Subtropical Agroecosystems, 15(3), 693-698. https://www.researchgate.net/publication/287187919_Micropropagation_of_agave_Agave_tequilana_Weber_var_Azul_through_axillary_buds
Arzate-Fernández, A. M., Piña-Escutia, J. L., Norman-Mondragón, T. H., Reyes-Díaz, J. I., Guevara-Suárez, K. L., y Vázquez-García, L. M. (2016). Regeneración de agave mezcalero (Agave angustifolia Haw.) a partir de embriones somáticos encapsulados. Revista Fitotecnia Mexicana, 39(4), 359-366. https://www.redalyc.org/journal/610/61049142004/html/
Aureoles-Rodríguez, F., Rodríguez-de la O., J. L., Legaria-Solano, J. P., Sahagún-Castellanos, J., y Peña O., M. G. (2008). Propagación in vitro del ‘Maguey bruto’ (Agave inaequidens koch), una especie amenazada de interés económico. Revista Chapingo Serie Horticultura, 14(3), 263-269. https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1027-152X2008000300006
Ávila-Lara, D. D., González-Montemayor, Á. M., Espinoza-Arellano, J. de J., Flores-Gallegos, A. C., y Rodríguez-Herrera, R. (2021). Rentabilidad de la producción de aguamiel en el sureste del estado de Coahuila, México: Un estudio de caso. Investigación y Ciencia de la Universidad Autónoma de Aguascalientes, 29(82), 61-71. https://www.redalyc.org/journal/674/67470553007/67470553007.pdf
Barrientos R., G., Esparza I., E. L., Segura P., H. R., Talavera M., Ó., Sampedro R., M. L., y Hernández C., E. (2019). Caracterización morfológica de Agave angustifolia y su conservación en Guerrero, México. Revista Mexicana de Ciencias Agrícolas, 10(3), 655-668. https://doi.org/10.29312/remexca.v10i3.1554
Bautista-Castellanos, A. I., Enríquez-del Valle, J. R., Velasco-Velasco, V. A., y Rodríguez-Ortiz, G. (2020). Enraizado de brotes in vitro y aclimatación de plantas de Agave potatorum Zucc. Ecosistemas y Recursos Agropecuarios, 7(3), Artículo e2618. https://doi.org/10.19136/era.a7n3.2618
Chávez-Ortiz, L. I., Morales-Domínguez, J. F., Rodríguez-Sahagún, A., & Pérez-Molphe-Balch, E. (2021). In vitro propagation of Agave guiengola Gentry using semisolid medium and temporary immersion bioreactors. Phyton-International Journal of Experimental Botany, 90(3), 1003-1013. https://doi.org/10.32604/phyton.2021.012862
Correa-Hernández, L., Baltazar-Bernal, O., Sánchez-Páez, R., y Bello-Bello, J. J. (2022). In vitro multiplication of agave tobala (Agave potatorum Zucc.) using Ebb-and-Flow biorreactor. South African Journal of Botany, 147, 670-677. https://doi.org/10.1016/j.sajb.2022.03.009
Cruz G., H., Campos Á., G. V., Enríquez del V., J. R., Velasco V., V. A., y Rodríguez O., G. (2017). Senescencia foliar en plantas micropropagadas de Agave americana durante su aclimatación. Revista Mexicana de Ciencias Agrícolas, 8(2), 381-391. https://doi.org/10.29312/remexca.v8i2.58
Domínguez R., M. S., Alpuche S., A. G., Vasco M., N. L., y Pérez M. B., E. (2008). Efecto de citocininas en la propagación in vitro de agaves mexicanos. Revista Fitotecnia Mexicana, 31(4), 317-322. https://revistafitotecniamexicana.org/documentos/31-4/3a.pdf
Enríquez del V., J. R., Carrillo C., G., y Rodríguez de la O, J. L. (2005). Sales inorgánicas y ácido indolbutírico en el enraizado in vitro de brotes de Agave angustifolia. Revista Fitotecnia Mexicana, 28(2), 175-178. https://www.redalyc.org/pdf/610/61028212.pdf
Faisal, M., Ahmad, N., Anis, M., Alatar, A. A., & Qahtan, A. A. (2018). Auxin-cytokinin synergism in vitro for producing genetically stable plants of Ruta graveolens using shoot tip meristems. Saudi Journal of Biological Sciences, 25(2), 273-277. https://doi.org/10.1016/j.sjbs.2017.09.009
Fatima, N., Ahmad, N., & Anis, M. (2011). Enhanced in vitro regeneration and change in photosynthetic pigments, biomass and proline content in Withania somnifera L. (Dunal) induced by copper and zinc ions. Plant Physiology and Biochemistry, 49(12), 1465-1471. https://doi.org/10.1016/j.plaphy.2011.08.011
Fragoso-Gadea, T., Gutiérrez, A., Coronado, M. L., Terrazas, T., Ramos-Clamont, G., Vázquez-Moreno, L., Álvarez-Bajo, O., y Esqueda, M. (2021). Poblaciones silvestres de Agave angustifolia (Asparagaceae) de Sonora, México: variación morfológica y contenido de azúcares. Acta Botánica Mexicana, (128), Artículo e1889. https://doi.org/10.21829/abm128.2021.1889
Garriga C., M., González O., G., Alemán G., S., Abreu C., E., Quiroz B., K., Caligari, P. D. S., & García-González, R. (2010). Management of auxin-cytokinin interactions to improve micropropagation protocol of henequen (Agave fourcroydes Lem.). Chilean Journal of Agricultural Research, 70(4), 545-551. http://dx.doi.org/10.4067/S0718-58392010000400003
Gayosso-Rodríguez, S., Borges-Gómez, L., Villanueva-Couoh, E., Estrada-Botello, M. A., y Garruña-Hernández, R. (2016). Sustratos para producción de flores. Agrociencia, 50(5), 617-631. https://www.agrociencia-colpos.org/index.php/agrociencia/article/view/1237/1237
Havlin, J. L., Tisdale, S. L., Nelson, W. L., & Beaton, J. D. (2016). Soil fertility and fertilizers. An introduction to nutrient management. Pearson India. https://www.researchgate.net/publication/366175716_Soil_Fertility_and_Fertilizers_by_John_L_Havlin_z-liborg
Instituto Nacional de Estadística y Geografía. (2019). Conjunto de datos vectoriales de información topográfica E14A58 (Tenancingo) escala 1:50 000 serie III. Mex. Mapas Topográficos. Escala 1:50 000. Serie III. México. https://datos.gob.mx/busca/dataset/mapas-topograficos-escala-1-50-000-serie-iii-mexico/resource/dcfed692-f291-4db3-9c9c-e5d6175b9476?inner_span=True
International Seed Testing Association. (2025). Chapter 2: Sampling. In ISTA (Edit.). International Rules for Seed Testing (Vol. 2025, pp. 1-48). ISTA. https://www.seedtest.org/api/rm/97C62HX4T55R346/ista-rules-2025-02-sampling-web.pdf
León V., N. I., Campos Á., G. V., Enríquez-del Valle, J. R., Velasco V., V. A., Marini Z., F., y Rodríguez O., G. (2013). Diversidad de especies de agave en San Miguel Tilquiapam, Ocotlán, Oaxaca. Revista Mexicana de Ciencias Agrícolas, (6), 1185-1195. https://doi.org/10.29312/remexca.v0i6.1282
Luna-Luna, S., Enríquez-del Valle, J. R., Rodríguez-Ortiz, G., Carrillo-Rodríguez, J. C., y Velasco-Velasco, V. A. (2017). Anatomía y morfología de plantas micropropagadas-aclimatadas de Agave potatorum Zucc. fertirrigadas en vivero. Revista Fitotecnia Mexicana, 40(4), 491-494. https://doi.org/10.35196/rfm.2017.4.491-494
Mandujano B., A., Pons H., J. L., Paredes M., R., y García M., P. (2018). Diversidad genética de maguey (Agave spp.) en las sierras y llanuras del norte de Guanajuato. Revista Mexicana de Ciencias Agrícolas, 9(3), 511-523. https://doi.org/10.29312/remexca.v9i3.1212
Miguel L., M. E., Enríquez-del Valle, J. R., Velasco V., V. A., Villegas A., Y., Carrillo R., J. C., y Rodríguez O., G. (2013). Composición del medio de cultivo y la incubación para enraizar brotes de Agave. Revista Mexicana de Ciencias Agrícolas, (6), 1151-1159. https://doi.org/10.29312/remexca.v0i6.1279
Miguel-Luna, M. E., González-Zafra, E. E., Enríquez-del Valle, J. R., Rodríguez-Ortiz, G., y de los Santos-Romero, R. B. (2023). Bencilaminopurina y sales minerales para la propagación in vitro de brotes de Agave nussaviorum. Revista Mexicana de Agroecosistemas, 10(S1), 3. https://revistaremaeitvo.mx/index.php/remae/article/view/53/45
Monja-Mio, K. M., Barredo-Pool, F., Herrera H., G., Esqueda V., M., & Robert, M. L. (2015). Development of the stomatal complex and leaf surface of Agave angustifolia Haw. ‘Bacanora’ plantlets during the in vitro to ex vitro transition process. Scientia Horticulturae, 189, 32-40. https://doi.org/10.1016/j.scienta.2015.03.032
Murashige, T., & Skoog, F. (1962). A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum, 15(3), 473-497. https://doi.org/10.1111/j.1399-3054.1962.tb08052.x
NOM-059-SEMARNAT-2010. (2010, 26 de noviembre). NORMA Oficial Mexicana NOM-059-SEMARNAT-2010, Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo. Diario Oficial de la Federación, Segunda Sección, de 30 de diciembre de 2010. http://biblioteca.semarnat.gob.mx/janium/Documentos/Ciga/agenda/DOFsr/DO2454.pdf
Osman, K. T. (2013). Soils. Principles, properties and management. Springer. https://books.google.com.mx/books?id=pZ0rVya6CW4C&printsec=frontcover&hl=es&source=gbs_ge_summary_r&cad=0#v=onepage&q&f=false
Pasternak, T. P., & Steinmacher, D. (2024). Plant growth regulation in cell and tissue culture in vitro. Plants, 13(2), 327. https://doi.org/10.3390/plants13020327
Pérez M. B., E., Esparza A., M. J., y Pérez R., M. E. (2012). Conservación in vitro de germoplasma de Agave spp. bajo condiciones de crecimiento retardado. Revista Fitotecnia Mexicana, 35(4), 279-287. https://www.scielo.org.mx/pdf/rfm/v35n4/v35n4a4.pdf
Portillo, L., Santacruz-Ruvalcaba, F., Gutiérrez-Mora, A., & Rodríguez-Garay, B. (2007). Somatic embryogenesis in Agave tequilana Weber cultivar Azul. In vitro Cellular & Developmental Biology-Plant, 43(6), 569-575. https://doi.org/10.1007/s11627-007-9046-5
Quinn, G. P., & Keough, M. J. (2002). Experimental design and data analysis for biologists. Cambridge University Press. https://www2.ib.unicamp.br/profs/fsantos/apostilas/Quinn%20&%20Keough.pdf
Ramírez-Malagón, R., Borodanenko, A., Pérez-Moreno, L., Salas-Araiza, M. D., Nuñez-Palenius, H. G., & Ochoa-Alejo, N. (2008). In vitro propagation of three Agave species used for liquor distillation and three for landscape. Plant Cell, Tissue and Organ Culture, 94, 201-207. https://doi.org/10.1007/s11240-008-9405-x
Ríos-Ramírez, S. C., Enríquez-del Valle, J. R., Rodríguez-Ortiz, G., & Ruíz-Luna, J. (2017). Benzylaminopurine and indol-3-acetic acid concentrations in in vitro proliferation of Agave angustifolia adventitious shoots. Ciencia e Investigación Agraria, 44(3), 285-294. http://dx.doi.org/10.7764/rcia.v44i3.1810
Rivera, J. L. y Lima, E. (2013). Efecto desorbedor del metanol en la membrana celular. TIP Revista Especializada en Ciencias Químico-Biológicas, 16(2), 93-97. https://www.scielo.org.mx/pdf/tip/v16n2/v16n2a2.pdf
Santacruz-Ruvalcaba, F., Castañeda-Nava, J. J., Villanueva-González, J. P., García-Sahagún, M. L., Portillo, L., y Contreras-Pacheco, M. L. (2022). Micropropagación de Agave maximiliana Baker por proliferación de yemas axilares. Polibotánica, (54), 139-151. https://doi.org/10.18387/polibotanica.54.9
Santíz, J. A., Rincón-Rosales, R., y Gutiérrez-Miceli, F. A. (2012). Propagación in vitro de Agave grijalvensis B. Ullrich, una especie endémica de Chiapas bajo protección especial. Gayana Botánica, 69, 23-30. http://www2.udec.cl/~gvalencia/pdf/GB2012_69_ne_Santiz_etal.pdf
Schenk, R. U., & Hildebrandt, A. C. (1972). Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Canadian Journal of Botany, 50(1), 199-204. https://doi.org/10.1139/b72-026
Secretaría de Medio Ambiente y Recursos Naturales. (2014). Especies de flora prioritarias para la conservación, 2014 (Número). Compendio de estadísticas ambientales 2018. https://apps1.semarnat.gob.mx:8443/dgeia/compendio_2018/dgeiawf.semarnat.gob.mx_8080/ibi_apps/WFServlet9529.html
Statistical Analysis System Institute. (2013). Base SAS® 9.4 Procedures Guide: Statistical Procedures. SAS Institute Inc. https://books.google.com.pa/books?id=M0TawAEACAAJ&hl=es&source=gbs_book_other_versions
Suárez P., I. E. (2020). Cultivo de tejidos vegetales. Fondo Editorial Universidad de Córdoba. https://repositorio.unicordoba.edu.co/entities/publication/800256e3-9997-4159-aae4-a0a2c5522852
Téllez T., A. G., Jiménez R., J. Á., González C., O., Juárez P., W. R., Martínez M., S., y Chávez Á., V. M. (2023). Cultivo in vitro de Agave potatorum, especie amenazada endémica de México. Botanical Sciences, 101(3), 883-894. https://doi.org/10.17129/botsci.3279
Zhang, Y. M., Li, X., Chen, Z., Li, J. F., Lu, J. Y., & Zhou, W. Z. (2013). Shoot organogenesis and plant regeneration in Agave hybrid, No. 11648. Scientia Horticulturae, 161, 30-34. https://doi.org/10.1016/j.scienta.2013.06.047
Published
How to Cite
Issue
Section
License
Copyright (c) 2025 Revista Mexicana de Ciencias Forestales

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
The authors who publish in Revista Mexicana de Ciencias Forestales accept the following conditions:
In accordance with copyright laws, Revista Mexicana de Ciencias Forestales recognizes and respects the authors’ moral right and ownership of property rights which will be transferred to the journal for dissemination in open access.
All the texts published by Revista Mexicana de Ciencias Forestales –with no exception– are distributed under a Creative Commons License Attribution-NonCommercial 4.0 International (CC BY-NC 4.0), which allows third parties to use the publication as long as the work’s authorship and its first publication in this journal are mentioned
The author(s) can enter into independent and additional contractual agreements for the nonexclusive distribution of the version of the article published in Revista Mexicana de Ciencias Forestales (for example, include it into an institutional repository or publish it in a book) as long as it is clearly and explicitly indicated that the work was published for the first time in Revista Mexicana de Ciencias Forestales.
For all the above, the authors shall send the form of Letter-transfer of Property Rights for the first publication duly filled in and signed by the author(s). This form must be sent as a PDF file to: ciencia.forestal2@inifap.gob.mx
This work is licensed under a Creative Commons Attribution-Noncommercial 4.0 International license.





