Disminución de la oxidación e inducción de estructuras proembriogénicas en Sideroxylon capiri (A. DC.) Pittier
DOI:
https://doi.org/10.29298/rmcf.v15i84.1454Palabras clave:
Tempisque, L-Cisteína, embriogénesis somática, recalcitrancia, fenoles totales, regeneraciónResumen
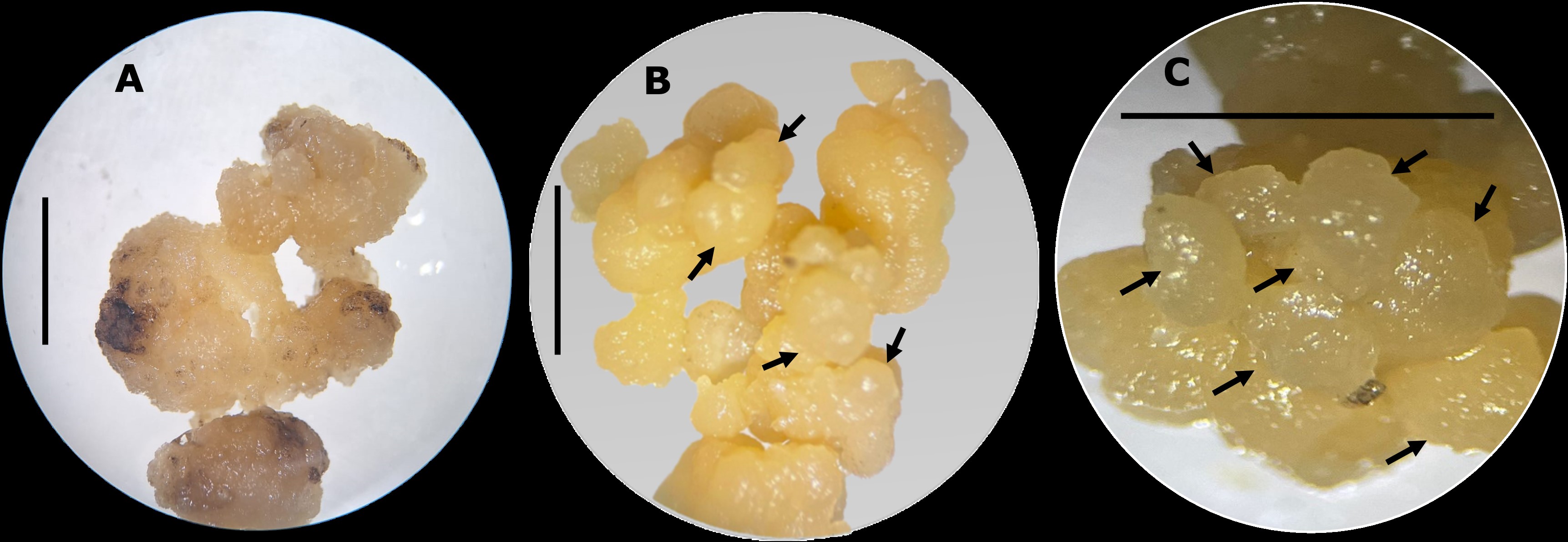
Sideroxylon capiri (tempisque) es un árbol tropical de la familia Sapotaceae, considerado de suma importancia debido a su papel biológico, uso tradicional y alto contenido de metabolitos secundarios de interés. No obstante, debido a factores tanto naturales como antropogénicos, en México se ha catalogado como una especie amenazada de acuerdo con la NOM-059-SEMARNAT-2010. Por lo anterior, es crucial el desarrollo de un protocolo de propagación in vitro para su conservación. En este contexto, se evaluó el efecto de los reguladores de crecimiento 6-Bencilaminopurina (BAP) y Picloram en la formación, proliferación y desarrollo de callo embriogénico y estructuras proembriogénicas, así como el efecto de la L-Cisteína en la reducción de la oxidación en callos, los cuales fueron expuestos a irradiación UV-B. Los resultados mostraron una respuesta positiva ante la aplicación de la combinación de BAP y Picloram en concentraciones de 4 y 2 mg L-1, respectivamente sobre el crecimiento de los callos. Además, se observó la generación de callos proembriogénicos en concentraciones de 0.5 y 1 mg L-1 de BAP y 1.5 y 2 mg L-1 de Picloram. Adicionalmente, se logró estandarizar un medio de cultivo que disminuyó los procesos de oxidación y pardeamiento en los callos mediante el uso de L-Cisteína en concentraciones de 100 a 200 mg L-1.
Descargas
Citas
Almazán-Núñez, R. C., E. A. Alvarez-Alvarez, P. Sierra-Morales and R. Rodríguez-Godínez. 2021. Fruit size and structure of zoochorous trees: Identifying drivers for the foraging preferences of fruit-eating birds in a Mexican successional dry forest. Animals 11(12):3343. Doi: 10.3390/ani11123343. DOI: https://doi.org/10.3390/ani11123343
Antúnez, P. 2022. Main environmental variables influencing the abundance of plant species under risk category. Journal of Forestry Research 33:1209-1217. Doi: 10.1007/s11676-021-01425-6. DOI: https://doi.org/10.1007/s11676-021-01425-6
Azofeifa, Á. 2009. Problemas de oxidación y oscurecimiento de explantes cultivados in vitro. Agronomía Mesoamericana 20(1):153-175. Doi: 10.15517/am.v20i1.4990. DOI: https://doi.org/10.15517/am.v20i1.4990
Barbosa F., J. C., I. M. de A. Silva-Cardoso, R. de Oliveira M. and J. E. Scherwinski-Pereira. 2022. Somatic embryogenesis and plant regeneration from zygotic embryos of the palm tree Euterpe precatoria Mart. Plant Cell, Tissue and Organ Culture 148:667-686. Doi: 10.1007/s11240-022-02227-2. DOI: https://doi.org/10.1007/s11240-022-02227-2
Cabañas-García, E., C. Areche, Y. A. Gómez-Aguirre, J. Borquez, … and E. Pérez-Malphe Balch. 2021. Biomass production and secondary metabolite identification in callus cultures of Coryphantha macromeris (Engelm.) Britton & Rose (Cactaceae), a traditional medicinal plant. South African Journal of Botany 137:1-9. Doi: 10.1016/j.sajb.2020.10.002. DOI: https://doi.org/10.1016/j.sajb.2020.10.002
Chukwunalu, O., M. Balogun, N. Maroya and R. Asiedu. 2018. Development of micropropagation system for yam (Dioscorea spp.) using somatic embryogenesis. International Institute of Tropical Agriculture (IITA). Ibadan, OY, Nigeria. 8 p. Doi: 10.13140/RG.2.2.17246.38726.
Cordero, J., F. Mesén, M. Montero, J. Stewart, … y G. Detlefsen. 2003. Descripciones de especies de árboles nativos de América Central. In: Cordero, J. y D. H. Boshier (Edits.). Arboles de Centroamérica, un Manual para el Extensionista. Centro Agronómico Tropical de Investigación y Enseñanza (CATIE). Turrialba, C, Costa Rica. pp. 311-959. https://books.google.com.mx/books?id=q-0NAQAAIAAJ&printsec=frontcover&hl=es&source=gbs_ge_summary_r&cad=0#v=onepage&q&f=false. (21 de agosto de 2023).
Cruz-Gutiérrez, E. J., L. M. Hernández-Fuentes and L. A. Gómez-Reyes. 2020. Uso de L-Cisteina para el control de oxidación in vitro de Annona muricata L. Revista Multidisciplinaria de Avances de Investigación 6(3):1-6. https://www.remai.ipn.mx/index.php/REMAI/article/view/75. (16 de mayo de 2023).
Díaz L., M. I., J. M. Rodas R., L. R. González S. y M. Vera de O. 2020. Establecimiento in vitro de segmentos nodales de Handroanthus heptaphyllus de flores blancas. Biotecnología Vegetal 20(3):203-210. https://revista.ibp.co.cu/index.php/BV/article/view/672. (21 de agosto de 2023).
Díaz M., M. G., Ó. Farrera S. y M. A. Isidro V. 2011. Estudio etnobotánico de los principales mercados de Tuxtla Gutiérrez, Chiapas, México. Lacandonia 5(2):21-42. https://repositorio.unicach.mx/handle/20.500.12753/1759. (13 de octubre de 2023).
García, E. G. y J. F. Di Stefano. 2005. Fenología del árbol Sideroxylon capiri (Sapotaceae) en el Bosque Seco Tropical de Costa Rica. Revista de Biología Tropical 53(1-2):5-14. Doi: 10.15517/rbt.v53i1-2.14292.
George, E. F., M. A. Hall and G.-J. De Klerk. 2008. Plant tissue culture procedure-Background. In: George, E. F., M. A. Hall and G.-J. De Klerk. (Edits.). Plant propagation by tissue culture. Springer. Dordrecht, ZH, The Netherlands. pp. 1-28. Doi: 10.1007/978-1-4020-5005-3_1. DOI: https://doi.org/10.1007/978-1-4020-5005-3_1
Hiramatsu, C., A. D. Melin, F. Aureli, C. M. Schaffner, M. Vorobyev and S. Kawamura. 2009. Interplay of olfaction and vision in fruit foraging of spider monkeys. Animal Behaviour 77(6):1421-1426. Doi: 10.1016/j.anbehav.2009.02.012. DOI: https://doi.org/10.1016/j.anbehav.2009.02.012
Iqbal, N., S. Umar, N. A. Khan and F. J. Corpas. 2021. Nitric oxide and hydrogen sulfide coordinately reduce glucose sensitivity and decrease oxidative stress via ascorbate-glutathione cycle in heat-stressed wheat (Triticum aestivum L.) plants. Antioxidants 10(1):108. Doi: 10.3390/antiox10010108. DOI: https://doi.org/10.3390/antiox10010108
Kamarul Z., M. A., A. M. Azzeme, I. K. Ramle, N. Normanshah, … and S. N. Akmar A. 2020. Induction, multiplication, and evaluation of antioxidant activity of Polyalthia bullata callus, a woody medicinal plant. Plants 9(12):1772. Doi: 10.3390/plants9121772. DOI: https://doi.org/10.3390/plants9121772
Koramutla, M. K., M. Negi and B. T. Ayele. 2021. Roles of glutathione in mediating abscisic acid signaling and its regulation of seed dormancy and drought tolerance. Genes 12(10):1620. Doi: 10.3390/genes12101620. DOI: https://doi.org/10.3390/genes12101620
Koufan, M., I. Belkoura, M. A. Mazri, A. Amarraque, … and T. Alaoui. 2020. Determination of antioxidant activity, total phenolics and fatty acids in essential oils and other extracts from callus culture, seeds and leaves of Argania spinosa (L.) Skeels. Plant Cell, Tissue and Organ Culture 141:217-227. Doi: 10.1007/s11240-020-01782-w. DOI: https://doi.org/10.1007/s11240-020-01782-w
Larsson, E., F. Sitbon, K. Ljung and S. von Arnold. 2008. Inhibited polar auxin transport results in aberrant embryo development in Norway spruce. New Phytologist 177(2):356-366. Doi: 10.1111/j.1469-8137.2007.02289.x. DOI: https://doi.org/10.1111/j.1469-8137.2007.02289.x
Lazos-Monterrosa, F. A., C. Orantes-García, O. Farrera-Sarmiento, A. G. Verdugo-Valdez, M. S. Sánchez-Cortés y L. E. Ruiz-Meza. 2015. Evaluación de la viabilidad y germinación de tempisque [Sideroxylon capiri (A. DC.) Pittier Sapotaceae]. Phyton Revista Internacional de Botánica Experimental 84(1):138-143. Doi: 10.32604/phyton.2015.84.138. DOI: https://doi.org/10.32604/phyton.2015.84.138
Li, S. M., H. X. Zheng, X. S. Zhang and N. Sui. 2021. Cytokinins as central regulators during plant growth and stress response. Plant Cell Reports 40:271-282. Doi: 10.1007/s00299-020-02612-1. DOI: https://doi.org/10.1007/s00299-020-02612-1
Li, Y., D. Kong, Y. Fu, M. R. Sussman and H. Wu. 2020. The effect of developmental and environmental factors on secondary metabolites in medicinal plants. Plant Physiology and Biochemistry 148:80-89. Doi: 10.1016/j.plaphy.2020.01.006. DOI: https://doi.org/10.1016/j.plaphy.2020.01.006
Liu, Y., C. Wei, H. Wang, X. Ma, H. Shen and L. Yang. 2021. Indirect somatic embryogenesis and regeneration of Fraxinus mandshurica plants via callus tissue. Journal of Forestry Research 32(4):1613-1625. Doi: 10.1007/s11676-020-01199-3. DOI: https://doi.org/10.1007/s11676-020-01199-3
Manoharan, R., J. N. Tripathi and L. Tripathi. 2016. Plant regeneration from axillary bud derived callus in white yam (Dioscorea rotundata). Plant Cell, Tissue and Organ Culture 126:481-497. Doi: 10.1007/s11240-016-1017-2. DOI: https://doi.org/10.1007/s11240-016-1017-2
Martínez-Silvestre, K. E., J. A. Santiz-Gómez, M. C. Luján-Hidalgo, N. Ruiz-Lau, Y. Sánchez-Roque and F. A. Gutiérrez-Miceli. 2022. Effect of UV-B radiation on flavonoids and phenols accumulation in Tempisque (Sideroxylon capiri Pittier) Callus. Plants 11(4):473. Doi: 10.3390/plants11040473. DOI: https://doi.org/10.3390/plants11040473
Mierziak, J., K. Kostyn and A. Kulma. 2014. Flavonoids as important molecules of plant interactions with the environment. Molecules 19(10):16240-16265. Doi: 10.3390/molecules191016240. DOI: https://doi.org/10.3390/molecules191016240
Mihai, R. A., E. J. Melo H., E. A. Pinto V., I. A. Espinoza C., … and L. I. Florescu. 2023. Somatic embryogenesis of representative medicinal trees in South America—Current status. Forests 14(10):2066. Doi: 10.3390/f14102066. DOI: https://doi.org/10.3390/f14102066
Newman, M. F. 2008. Flora del Valle de Tehuacán-Cuicatlán, Fascículo 57. Sapotaceae Juss. Instituto de Biología de la Universidad Nacional Autónoma de México. Coyoacán, D. F., México. 20 p.
Pancaningtyas, S. 2015. Study on the presence and influence of phenolic compounds in callogenesis and somatic embryo development of cocoa (Theobroma cacao L.). Pelita Perkebunan 31(1):14-20. Doi: 10.22302/iccri.jur.pelitaperkebunan.v31i1.81. DOI: https://doi.org/10.22302/iccri.jur.pelitaperkebunan.v31i1.81
Quiñones A., M., N. Yafac, R. Garavito-Salini y L. Príncipe. 2020. Desdiferenciación celular in vitro de Coffea arabica L. “Café” var. caturra a partir de explantes foliares. Scientia 22(22):141-148. Doi: 10.31381/scientia.v22i22.3573. DOI: https://doi.org/10.31381/scientia.v22i22.3573
Rajput, D. S., T. S. Rathore, S. A. Ansari, M. Faisal, … and A. Shahzad. 2023. Biochemical changes in embryogenic and non-embryogenic callus of Bambusa nutans Wall. during somatic embryogenesis. Plant Cell, Tissue and Organ Culture 155(1):127-135. Doi: 10.1007/s11240-023-02559-7. DOI: https://doi.org/10.1007/s11240-023-02559-7
Richard-Forget, F. C., P. M. Goupy and J. J. Nicolas. 1992. Cysteine as an inhibitor of enzymic browning. 2. Kinetic studies. Journal of Agricultural and Food Chemistry 40(11):2108-2113. Doi: 10.1021/jf00023a014. DOI: https://doi.org/10.1021/jf00023a014
Robles-García, M. A., J. Aguilar A., M. Gutiérrez-Lomelí, F. Rodríguez-Félix, … y C. L. Del-Toro-Sánchez. 2016. Identificación cualitativa de metabolitos secundarios y determinación de la citotoxicidad de extractos de tempisque (Sideroxylom capiri Pittier). Biotecnia 18(3):3-8. Doi: 10.18633/biotecnia.v18i3.328. DOI: https://doi.org/10.18633/biotecnia.v18i3.328
Rodríguez B., M. M., M. I. Latsague V., M. A. Chacón F. y P. K. Astorga B. 2014. Inducción in vitro de callogénesis y organogénesis indirecta a partir de explantes de cotiledón, hipocótilo y hoja en Ugni molinae. Bosque 35(1):111-118. Doi: 10.4067/S0717-92002014000100011. DOI: https://doi.org/10.4067/S0717-92002014000100011
Sánchez J., K., R. Cabrera P. y J. Jiménez D. 2019. Inducción de embriogénesis somática a partir de explantes foliares en tres variedades de café. Scientia Agropecuaria 10(2):259-264. Doi: 10.17268/sci.agropecu.2019.02.11. DOI: https://doi.org/10.17268/sci.agropecu.2019.02.11
Secretaría de Medio Ambiente y Recursos Naturales (Semarnat). 2010. Norma Oficial Mexicana NOM-059-SEMARNAT-2010 Protección Ambiental-Especies Nativas de México de Flora y Fauna Silvestres-Categorías de Riesgo y Especificaciones Para Su Inclusión, Exclusión o Cambio-Lista de Especies en Riesgo. Diario Oficial de la Federación. 30 de diciembre de 2010. México, D. F., Mexico. 78 p.
StatPoint Technologies Inc. 2010. Statgraphics Centurion XVI.II. Warrenton, VA, United States of America. StatPoint Technologies, Inc.
Su, Y. H., Y. B. Liu, B. Bai and X. S. Zhang. 2015. Establishment of embryonic shoot–root axis is involved in auxin and cytokinin response during Arabidopsis somatic embryogenesis. Frontiers in Plant Science 5:792. Doi: 10.3389/fpls.2014.00792. DOI: https://doi.org/10.3389/fpls.2014.00792
Vásquez-Hernández, S., C. A. Cruz-Cruz, M. Santiago-Santiago and J. J. Bello-Bello. 2021. Evaluation of different antioxidants during in vitro establishment of allspice (Pimenta dioica L. Merrill): a recalcitrant species. Agro Productividad 14(11):149-157. Doi: 10.32854/agrop.v14i11.2167. DOI: https://doi.org/10.32854/agrop.v14i11.2167
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2024 Revista Mexicana de Ciencias Forestales

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores que publiquen en la Revista Mexicana de Ciencias Forestales aceptan las siguientes condiciones:
De acuerdo con la legislación de derechos de autor, la Revista Mexicana de Ciencias Forestales reconoce y respeta el derecho moral de los autores, así como la titularidad del derecho patrimonial, el cual será cedido a la revista para su difusión en acceso abierto.
Todos los textos publicados por la Revista Mexicana de Ciencias Forestales –sin excepción– se distribuyen amparados bajo la licenciaCreative Commons 4.0 Atribución-No Comercial (CC BY-NC 4.0 Internacional), que permite a terceros utilizar lo publicado siempre que mencionen la autoría del trabajo y a la primera publicación en esta revista. (no permite el uso comercial)
Los autores pueden realizar otros acuerdos contractuales independientes y adicionales para la distribución no exclusiva de la versión del artículo publicado en la Revista Mexicana de Ciencias Forestales (por ejemplo, incluirlo en un repositorio institucional o darlo a conocer en otros medios en papel o electrónicos) siempre que indique clara y explícitamente que el trabajo se publicó por primera vez en la Revista Mexicana de Ciencias Forestales.
Para todo lo anterior, los autores deben remitir el formato de carta-cesión de la propiedad de los derechos de la primera publicación debidamente requisitado y firmado por los autores/as. Este formato debe ser remitido en archivo PDF al correo: editorial.forestal@inifap.gob.mx
Esta obra está bajo una licencia de Creative Commons Reconocimiento-No Comercial 4.0 Internacional.





